- I. PENDAHULUAN
Pengendalian Orgenisme Pengganggu Tumbuhan (OPT) dengan mengedepankan prinsip ramah lingkungan dan tidak mengganggu keseimbangan alam menuntut tanggungjawab yang besar dari para pelaku perlindungan perkebunan. Penerapan PHT dengan memadukan berbagai cara pengendalian yang kompatibel merupakan langkah yang tepat untuk mengendalikan OPT. Penerapan PHT tersebut antara lain dengan memanfaatkan penggunaan Agens Pengendali Hayati untuk pengendalian OPT.
Dalam perkembangannya ada dua macam teknologi untuk pengembangan agens pengendali hayati jenis jamur yaitu media cair dan media padat. Pengembangan media cair menggunakan media ekstrak kentang gula dan media padat menggunakan media jagung.
Pemanfaatan bekatul telah diujikan dalam media padat jagung giling untuk perbanyakan massal agensia Metarhizium anisopliae dan Beauveria bassiana, akan tetapi belum didapatkan hasil yang memuaskan, oleh karena itu diperlukan pengujian lebih lanjut untuk mengetahui media yang tepat dengan harga yang murah akan tetapi tidak mengurangi kualitas dari agensia tersebut.
Pemanfaatan kulit kakao dan kulit kopi sebagai media alternative perbanyakan massal jamur Metarhizium dan Beauveria perlu dipertimbangkan, mengingat limbah tersebut melimpah. kulit buah kakao (KBK) merupakan limbah utama dari pengolahan coklat yang mencakup sekitar 70% dari keseluruhan buah, mengandung air sekitar 84%, serat kasar 27%, dan protein 8% (Purnama,2004)
1.2.Tujuan
- Mengetahui beberapa media alternatif untuk perbanyakan massal agensia pengendali hayati.
- Mendapatkan media yang terbaik untuk perbanyakan agens pengendali hayati tanpa mengurangi kualitas agens hayati tersebut.
Mendapatkan media alternatif yang tepat dan murah untuk perbanyakan massal agensia hayati namun tidak mengurangi mutu dan kualitas agensia pengendali hayati tersebut.
1.4. Waktu pelaksanaan
Kegiatan ini dilaksanakan pada bulan April sampai dengan September 2007.
1.5. Lokasi kegiatan
Lokasi kegiatan dilaksanakan di laboratorium Balai Proteksi Tanaman Perkebunan Jawa Timur.
1.6. Sumber dana
Kegiatan ini didanai APBN Satker BPTP Jatim Tahun Anggaran 2007.
1.7. Pelaksana kegiatan
Pelaksana kegiatan : 1. Vikayanti, S.Si.
2. Umiati, SP.
- Dina Ernawati, SP.
- Cahyo Artho N, Amd.
- Gris Anjasanta
- Ruri Febrianti.
- Djoko Nugroho
2.1. Klasifikasi Metarhizium anisopliae
Taksonomi dan morfologi
Kingdom : Fungi
Divisi : Eumycota
Kelas : Deuteromycetes
Ordo : Moniliales
Famili : Moniliaceae
Genus : Metarhizium anisopliae (Ainsworth, 1973)
Morfologi dari Metarhizium yang telah banyak diketahui yaitu konidiofor tumbuh tegak, spora berbentuk silinder atau lonjong dengan panjang 6-16 mm, warna hialin, bersel satu, massa spora berwarna hijau zaitun. Metarhizium sp. tumbuh pada pH 3,3-8,5 dan memerlukan kelembaban tinggi. Radiasi sinar matahari dapat menyebabkan kerusakan pada spora. Suhu optimum bagi pertumbuhan dan perkembangan spora berkisar pada 25-30oC. Metarhizium mempunyai miselia yang bersepta, dengan konidia yang berbentuk lonjong. Metarhizium anisopliae bersifat saprofit pada media buatan, awal mula pertumbuahannya adalah tumbuhnya konidium yang membengkak dan mengeluarkan tabung-tabung kecambah (Anonymous,1999).

Gambar 1.Isolat murni Metarhizium anisopliae
Tabung kecambah tersebut memanjang dan memanjang selama 30 jam.
Beberapa cabang tersebut membesar kearah atas membentuk konidiofor yang
pendek, bercabang, berdekatan dan saling melilit. Konidia terbentuk
setelah satu minggu pertumbuhan, mula-mula berwarna putih kemudian
berangsur menjadi hijau apabila telah masak. Pembentukan konidia
terdiri dari kuncup dan tunas yang memanjang pada kedua sisi konidiofor
tersebut. Umumnya sebuah rantai konidia bersatu membentuk sebuah kerak
dalam media (Gabriel dan Riyatno, 1989).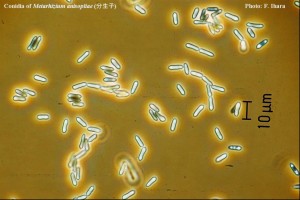
Gambar 2. Konidia Metarhizium anisopliae
Spesias pertama genus Metarhizium (Subdivision Deteromycotina; Class Hyphomycetes; Order Moniliales). Metarhizium anisopliae, diisolasi dari serangga Coleoptera spesies Anisopliae austriacaI oleh Metchnikoff pada tahun 1878. Metarhizium spp. biasanya ada dimana-mana di seluruh dunia dalam fase yang berbeda-beda, yaitu diantara fase saprofit tanah dan fase patogen pada serangga. Metarhizium spp. (termasuk M. anisopliae, M. flavoviride, M. album dan M. brunneum) secara umum mempunyai sasaran inang yang luas.
Gambar 3. Perkecambahan Metarhizium anisopliae
Dibawah kondisi alami, Metarhizium spp. menghasilkan dua jenis spora. Aerial conidia yang dihasilkan pada phialid-phialid selama fase saprofitik atau pada inang yang telah mati, dan didefinisikan sebagai spora-spora aseksual yang dihasilkan pada sporogenous dan hifa khusus yang dikenal sebagai phialid. Tipe spora yang kedua adalah spora yang dihasilkan di hemolymph serangga yang biasanya disebut “blastospora”(Taborsky,1992).
2.2. Taksonomi dan Morfologi Beauveria bassiana
Kingdom : Fungi
Divisi : Deuteromycotina
Kelas : Deuteromycetes
Ordo : Moniliales
Famili : Moniliaceae
Genus : Beauveria
Spesies : Beauveria bassiana (Alexopoulos and Mims, 1979).
Beauveria bassiana memiliki spora berbentuk bulat, bersel satu, hialin, dan berbentuk secara tunggal pada sterigma yang pendek. Konidium B. bassiana dihasilkan secara aseksual, konidium ini terbentuk pada ujung dan sisi-sisi konidiofor, dan melekat pada sterigma yang pendek. Konidium terbentuk secara soliter, pertumbuhannya mengikuti pola berselang seling, sehingga setelah konidium masak dan terlepas dari konidiofornya nampak berbentuk zig-zag (Suharto et.al., 1998)
Gambar 3. Morfologi Beauveria bassiana
Perkecambahan konidium menghendaki atmosfer yang jenuh dan temperatur optimal untuk pertumbuhannya berkisar antara 25 – 30 0C, minimum 10 0C dan maksimal 32 0C, tergantung pada geografi asli dari isolat. Perkecambahan tidak
terjadi di bawah 10 0C atau di atas 35 0C. Titik temperatur kematian konidium diketahui pada 50 0C selama 10 menit di air. pH optimal untuk pertumbuhannya adalah 5,7-5,9 dan untuk pembentukan konidium 7-8 (Domsch et.al., 1993).
B. bassiana mengadakan penetrasi ke dalam tubuh serangga melalui kulit di antara ruas-ruas tubuh. Mekanisme penetrasinya dimulai dengan pertumbuhan spora pada kutikula, selanjutnya hifa jamur mengeluarkan enzim kitinase, lipase, dan proteinase yang mampu menguraikan kutikula serangga. Di dalam tubuh serangga, hifa B. bassiana juga menhasilkan beberapa toksin seperti beauverisin, bassianolit, isorolit, dan asam oksalat yang mekanisme kerjanya menyebabkan terjadinya kenaikan pH hemolymph, penggumpalan hemolymph, dan terhentinya peredaran hemolymph (Robert, 1981).
2.3. Faktor-faktor Yang Mempengaruhi Pertumbuhan Dan Perkembangan
Metarhizium anisopliae dan Beauveria bassiana
- Suhu Dan Kelembaban
Suhu dan kelembaban sangat mempengaruhi pertumbuhan jamur Metarhizium terutama untuk pertumbuhan dan perkecambahan konidia serta patogenesitasnya. Batasan suhu untuk pertumbuhan jamur antara 5-35oC, pertumbuhan optimal terjadi pada suhu 23-25oC. Konidia akan tumbuh dengan baik dan maksimum pada kelembaban 80-92 persen (Burges dan Hussey, 1971).
- Sinar Matahari
- Derajat Keasaman (pH)
2.4.Kebutuhan Nutrisi Jamur Metarhizium anisopliae dan Beauveria bassiana
Ferron (1981) berpendapat bahwa sumber nutrisi dapat berpengaruh pada pertumbuhan jamur entomopatogen. Inglod (1962) menyebutkan bahwa media jamur harus mengandung subtansi organik sebagai sumber C, sumber N, ion anorganik dalam jumlah yang cukup sebagai pemasok pertumbuhan dan sumber vitamin. Metarhizium anisopliae juga memerlukan karbohidrat sebagai sumber karbon dalam pertumbuhannya. Sejumlah penelitian menurut (Bilgrami dan Verma (1981) menunjukkan bahwa penggunaan karbohidrat tinggi mendorong pertumbuhan vegetatif jamur.
Pembentukan konidia jamur dipengaruhi oleh kandungan protein dalam media. Protein diperlukan untuk pembentukan organel yang berperan dalam pembentukan apikal hifa dan sintesis enzim yang diperlukan selama proses tersebut dan enzim juga berperan dalam aktivitas perkecambahan dan protein yang diserap dalam bentuk asam amino (Garraway dan Evans, 1984).
Jamur entomopatogen membutuhkan oksigen, air dan sumber organik karbon dan energi. Sumber nitrogen baik organik maupun anorganik dan bahan tambahan lain berupa mineral maupun pemacu tumbuh juga diperlukan. Sumber karbon yang biasa digunakan sebagai media adalah dekstrose namun dapat diganti dengan polisakarida seperti tajin atau lipid. Nitrogen dapat disediakan dalam bentuk nitrat, amonia atau bahan organik seperti asam amino atau protein. Makronutrisi penting yang lain adalah phospor (dalam bentuk phospat), potassium, magnesium dan sulfur ( yang disediakan dalam bentuk sulfat maupun dalam bentuk organik, cystein atau methionine). Mikronutrisi penting yang dibutuhkan oleh kebanyakan jamur entomopatogen adalah kalsium, besi, tembaga, mangan, molybdenum, zinc dan vitamin B komplek, khususnya biothine dan thiamine. Semua mikronutrisi ini biasanya terdapat dalam bahan mentah, akan tetapi dapat dipenuhi dalam bentuk protein hidrolisat atau ekstrak yeast (Taborsky, 1992).
2.5. Tinjauan media yang digunakan
Jamur adalah mikroorganisme heterotrof karena tidak memiliki kemampuan untuk mengoksidasi senyawa karbon anorganik, atau senyawa karbon yan memiliki satu karbon. Senyawa karbon organik yang dapat dimanfaatkan fungi untuk membuat materi sel baru berkisar dari molekul sederhana seperti gula sederhana dan asam organik, hingga kepada senyawa kompleks seperti karbohidrat, protein, lipid, dan asam nukleat (Rhoosheroe dan Sjamsuridzal, 2006). Kentang, beras, dan jagung merupakan bahan makanan yang mengandung karbohidrat dan mudah ditemukan di Indonesia, selain itu harganya pun juga murah.
- a. Jagung
Tabel 1. Kandungan Zat Gizi Jagung
No |
Zat Gizi |
Kandungan (Tiap 100 gr bahan) |
1 |
Energi (cal) |
129 |
2 |
Protein (gr) |
4,1 |
3 |
Lemak (gr) |
1.3 |
4 |
Karbohidrat (gr) |
30.3 |
5 |
Kalsium (mg) |
5.0 |
6 |
Fosfor (mg) |
108.0 |
7 |
Besi (mg) |
1.1 |
8 |
Vitamin A (SI) |
117.0 |
9 |
Vitamin B (mg) |
0.18 |
10 |
Vitamin C (mg) |
9.0 |
11 |
Air (gr) |
63.5 |
- b. Bekatul
Bekatul adalah limbah hasil dari proses penggilingan padi. Menurut Grist (1986) dan Muchtadi, dkk (1995) dalam Ismnz (2006), bekatul merupakan hasil sampingan dari pengolahan padi/gabah yang berasal dari lapisan luar beras pecah kulit yang terdiri dari perikarp, lapisan aleuron, embrio, dan sedikit endosperm.Bekatul merupakan sumber serat pangan yang juga mengandung protein, lemak, mineral dan vitamin (Muchtadi, Nienaber dan Susana, 1995 dalam Ismnz, 2006). Kandungan vitamin yang terdapat pada bekatul antara lain seperti tiamin, riboflavin dan niasin sedangkan kandungan mineral yang dimiliki bekatul antara lain, seperti alumunium, kalsium, klor, besi, magnesium, mangan, fosfor, kalium, silikon, natrium dan seng (Betty, 2000 dalam Ismnz, 2006).
Dengan pertimbangan ketersediaan yang cukup serta nilai gizi bekatul yang tinggi, yaitu terdiri atas protein 14 persen, lemak 18 persen, karbohidrat 36 persen, abu 10 persen, serat kasar 12 persen, serta berbagai vitamin, hasil samping ini sangat potensial untuk dikembangkan (Pasopati, 2005).
c. Kulit kakao
Berdasarkan analisis kimia, limbah kakao mengandung zat-zat makanan yang dapat dimanfaatkan untuk pakan. Menurut Zainuddin et al. (1995) kulit buah kakao mengandung 16,5 persen protein, 16,5 MJ/Kj kalori dan 9,8 persen lemak. Penggunaan pada ayam pedaging hingga 5 persen tidak berpengaruh negatif terhadap
pertumbuhan, sedangkan penggunaan di atas level tersebut dapat menyebabkan menurunnya pertumbuhan karena adanya zat-zat penghambat pencernaan seperti tanin atau asam phitat yang berpengaruh terhadap penyerapan zat-zat makan-
an (Zainuddin et al.,1995). Melalui proses fer-mentasi dengan Aspergillus niger, kandungan protein kasar kulit buah kakao dapat ditingkatkan dari 15 persen menjadi 19-20 persen (Kompiang, 2000).
Kulit buah kakao (shel fod husk) adalah merupakan limbah agroindustri yang
dihasilkan tanaman kakao (Theobroma cacao L.) Buah coklat yang terdiri dari 74 % kulit buah, 2 % plasenta dan 24 % biji. Hasil analisa proksimat mengandung 22 % protein dan 3-9 % lemak (Nasrullah dan A. Ella, 1993). Pakar lain menyatakan kulit buah kakao kandungan gizinya terdiri dari bahan kering (BK) 88 % protein kasar (PK) 8 %, serat kasar (SK) 40,1 % dan TDN 50,8 % dan penggunaannya oleh ternak ruminansia 30-40 % dilaporkan oleh Anonimus (2001). Dari hasil penelitian yang dilakukan pada ternak domba, bahwa penggunaan kulit buah kakao dapat digunakan sebagai substitusi suplemen sebanyak 15 % atau 5 % dari ransum. Sebaiknya sebelum digunakan sebagai pakan ternak, limbah kulit buah kakao perlu difermentasikan terlebih dahulu untuk menurunkan kadar lignin yang sulit dicerna oleh hewan dan untuk meningkatkan kadar protein dari 6-8 % menjadi 12-15 %. Pemberian kulit buah kakao yang telah diproses pada ternak sapi dapat meningkatkan berat badan sapi sebesar 0,9 kg/ hari.
Kandungan nutrisi limbah (kulit buah) kakao menurut Guntoro dan Yasa (2002)
Tabel. 2 Kandungan Nutrisi Limbah Kulit Kakao
| Perlakuan limbah | Kandungan nutrisi | |||||
| Protein kasar | Serat kasar | Lemak | Kalsium | Fosfor | ||
| Non-Fermentasi | 10,88 | 7,10 | 2,11 | 0,10 | 0,05 | |
| Fermentasi konvensional | 12,12 | 6,42 | 2,02 | 0,11 | 0,08 | |
| Fermentasi dengan | 17,12 | 4,15 | 2,08 | 0,11 | 0,08 | |
| Aspergillus niger | ||||||
Gandjar dan Sjamsuridzal (2006) menyatakan bahwa setiap organisme, termasuk jamur mempunyai kurva pertumbuhan, begitu pula fungi. Kurva tersebut diperoleh dari menghitung massa sel dalam waktu tertentu. Kurva pertumbuhan mempunyai beberapa fase antara lain :
- Fase lag, yaitu fase penyesuaian sel-sel dengan lingkungan dan pembentukan enzim-enzim untuk mengurai substrat.
- Fase akselerasi, yaitu fase mulainya sel-sel membelah dan fase lag menjadi fase aktif.
- Fase eksponensial, merupakan fase perbanyakan jumlah sel yang sangat banyak, aktifitas sel sangat meningkat, dan fase ini merupakan fase yang penting dalam kehidupan fungi.
- Fase deselerasi (Moore-landecker, 1996), yaitu fase dimana sel-sel kurang aktif membelah.
- Fase stasioner, yaitu fase dimana jumlah sel yang bertambah dan jumlah sel yang mati relatif seimbang. Kurva pada fase ini merupakan garis lurus yang horizontal.
- Fase kematian dipercepat, jumlah sel-sel yang mati atau tidak aktif lebih banyak daripada sel-sel yang masih hidup.
|
Keterangan :
(1) fase lag; (2) fase akselerasi; (3) fase eksponensial ; (4) fase deselerasi ; (5) fase stasioner ; (6) fase kematian dipercepat
III. CARA KERJA DAN PELAKSANAAN
3.1.Metode Penelitian
Hasil kegiatan dianalisa dengan menggunakan rancangan acak lengkap pada:
a. Jamur Metarhizium anisopliae menggunakan 4 perlakuan dan 3 ulangan, yaitu :
A = pelakuan dengan media jagung (kontrol)
B = perlakuan dengan media bekatul
C = perlakuan dengan media jagung : bekatul = 1 : 1
D = perlakuan dengan media jagung : bekatul = 1 : 2
b. Jamur Beauveria bassiana menggunakan 8 perlakuan dan 3 ulangan, yaitu :
A = perlakuan dengan media jagung (kontrol)
B = perlakuan dengan media bekatul
C = perlakuan dengan media kulit kopi
D = perlakuan dengan media kulit kakao
E = perlakuan dengan media jagung : bekatul = 1 : 1
F = perlakuan dengan media jagung : bekatul = 1 : 2
G = perlakuan dengan media kulit kopi : kulit kakao = 1 : 1
H = perlakuan dengan media kulit kopi : kulit kakao = 1 : 2
3.2. Bahan dan alat
- Bahan
- Alat
3.3.Cara Kerja
1. Persiapan Kegiatan
a. Pembuatan Media
Media yang digunakan ada 6 macam media dengan cara pembuatan sebagai berikut
- Media jagung
Jagung giling dicuci bersih kemudian jagung ditanak sampai setengah
matang, kemudian dinginkan. Jagung giling tersebut kemudian ditiriskan
dan dimasukkan ke dalam plastik tahan panas berukuran 10 x 20 cm hingga
mencapai 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu
1200C dengan tekanan 1,5 atm selama 60 menit. Setelah medium dingin, medium siap untuk diinokulasi.
- Media bekatulBekatul dibasahi dengan air hangat hingga agak lembab. Kemudian dimasukkan ke dalam plastik tahan panas berukuran 10 x 20 cm hingga mencapai 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu 1200C dengan tekanan 1,5 atm selama 60 menit. Setelah medium dingin, medium siap untuk diinokulasi.
- Media jagung dan bekatul
Jagung dikukus setengah matang, kemudian didinginkan. Bekatul dibasahi hingga agak lembab, kemudian dicampur dengan jagung yang telah dingin, sesuai dengan perbandingan yang telah ditetapkan. Media yang sudah dingin dikemas kedalam kantong plastik berukuran 10 x 20 cm, plastik tersebut diisi 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu 1200C dengan tekanan 1,5 atm selama 60 menit. Setelah medium dingin, medium siap untuk diinokulasi.
- Media kulit kopi
Kulit kopi yang telah hancur dibasahi dengan air menggunakan sprayer hingga agak lembab. Kemudian media dikemas kedalam kantong plastik berukuran 10 x 20 cm, plastik tersebut diisi 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu 1200C dengan tekanan 1,5 atm selama 60 menit. Setelah medium dingin, medium siap untuk diinokulasi.
- Media kulit kakao
Kulit kakao yang telah dipecah dan dihilangkan bijinya dicuci bersih kemudian dipotong-potong dan diiris tipis-tipis untuk mempercepat proses pengeringan kulit kakao. Irisan-irisan kulit kakao tersebut lalu dijemur hingga benar-benar kering. Setelah itu kulit kakao dibasahi dengan air menggunakan sprayer hingga agak lembab.Kemudian dimasukkan ke dalam plastik tahan panas berukuran 10 x 20 cm hingga 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu 1200C dengan tekanan 1,5 atm selama 30 menit. Setelah medium dingin, medium siap untuk diinokulasi.
- Media kulit kopi dan kulit kakao
Kulit kopi yang telah siap dicampur dengan kulit kakao sesuai dengan perbandingan yang ditentukan. Kemudian dimasukkan ke dalam plastik tahan panas berukuran 10 x 20 cm hingga 1/3 bagian. Medium siap untuk disterilkan di autoklaf pada suhu 1200C dengan tekanan 1,5 atm selama 30 menit. Setelah medium dingin, medium siap untuk diinokulasi.
Setiap media sebelum disterilisasi ditimbang dahulu baik berat sebelum dimasak atau dibasahi dengan air (berat kering) dan berat setelah dimasak atau dibasahi dengan air (berat basah) untuk menghitung kadar air masing-masing media.
Kadar air (%) =
- 2. Pengamatan
a. Perhitungan jumlah spora
1 Teteskan larutan agensia hayati yang akan dicek virulensinya diatas haemacytometer dan letakkan cover glass diatasnya.
2 Tekan cover glass pelan-pelan dan biarkan sampai 5 menit agar larutan tenang.
3 Hitunglah spora pada kotak 1 dan kotak 2, kemudian dirata-rata.
|
a. Untuk spora besar
Misal : Metarhizium anisopliae
|
Misal : Beauveria bassiana
|
|
b. Perhitungan Viabilitas Spora
1 Untuk mengetahui viabilitas spora umur biakan yang digunakan berkisar 10 – 12 hari. Idealnya viabilitas yang bagus adalah 100%. Namun apabila semakin lama disimpan, viabilitas akan menurun . Media yang bagus dapat bertahan sampai 2 tahun.
2 Ambil spora pada biakan yang sudah disiapkan, dan pindahkan dengan jarum ose dan lakukan pengenceran berseri. Apabila perlu masukkan sedikit detergent dengan menggunakan ujung ose dan goyangkan.
3 Inkubasikan selama 18-24 jam.
4 Tambahkan setetes lactofenol/cotton blue diatas permukaan media pada masing-masing petri.
5 Letakkan beberapa cover glass diatas permukaan media pada masing-masing petri.
6 Amati dibawah mikroskop dengan tutup petri terbuka dengan perbesaran 100x.
7 Hitung minimum 200 spora, lebih banyak akan lebih representatif.
8 Yang dihitung adalah spora yang berkecambah dengan diameter ³ 2 x diameter spora.
9 Setiap konsentrasi dilakukan 3 kali ulangan.
10 % perkecambahan = spora berkecambah x 100 % spora tidak berkecambah
- Ambil 3 kultur media dalam petridish dan tambahkan diatasnya 0,1 ml hasil pengenceran. Kemudian diratakan.
| Jamur | Perlakuan | Jumlah spora (gr/ml) | Viabilitas (%) | |||||||
| Pengamatan ke- | Pengamatan ke- | |||||||||
| I | II | III | IV | I | II | III | IV | |||
| Beauveria bassiana | Jagung | 259,722,2 | - | 9,225,000 | 10,350,000 | 0 | - | 0 | 0 | |
| Bekatul | 0 | - | 4,675,000 | Kontaminasi | 0 | - | 0 | 0 | ||
| J1B1 | 125,000 | - | 6,000,000 | Kontaminasi | 0 | - | 0 | 0 | ||
| J1B2 | 1,058,333 | - | Kontaminasi | 0 | - | 0 | 0 | |||
| Kakao | Kontaminasi | 0 | - | 0 | 0 | |||||
| Kopi | Kontaminasi | 0 | - | 0 | 0 | |||||
| Ko1Ka1 | Kontaminasi | 0 | - | 0 | 0 | |||||
| Ko1Ka2 | Kontaminasi | 0 | - | 0 | 0 | |||||
| Metarhizium anisopliae | Jagung | 411,000 | - | 1,389,000 | 6,288,000 | 0 | - | 0 | 0 | |
| Bekatul | 24,000 | - | Kontaminasi | 0 | - | 0 | 0 | |||
| J1B1 | Kontaminasi | 0 | - | 0 | 0 | |||||
| J1B2 | 68,000 | - | Kontaminasi | 0 | - | 0 | 0 | |||
- IV. Hasil dan Pembahasan
Tabel 3. Jumlah Spora dan Viabilitas
Dari hasil pengamatan dapat diketahui bahwa perlakuan dengan media jagung menghasilkan rata-rata jumlah spora tertinggi pada jamur Beauveria maupun Metarhizium. Hal tersebut karena kandungan nutrisi jagung lebih tinggi dibandingkan dengan bekatul, kulit kopi maupun kulit kakao. Dengan kandungan karbohidrat sebesar 30.3 % per 100 gram dan protein 4,1 % mampu memberikan suplai energi sebesar 109 %. Dengan kandungan nutrsi tersebut jagung sangat cocok digunakan sebagai media perbanyakan jamur. Namun nilai ekonomis jagung yang cukup tinggi. Salah satunya digunakan sebagai bahan pangan masyarakat maka perlu dilakukan modifikasi media tumbuh jamur Metarhizium dan Beauveria. Pemanfaatan bekatul serta beberapa jenis limbah pertanian, kulit kopi dan kulit kakao diharapkan mampu mengurangi kebutuhan jagung sebagai media tumbuh jamur. Dari hasil uji media pemanfaatan bekatul, kulit kopi serta kulit kakao. Ternyata hasil uji belum memuaskan. Hal ini berdasar hasil penghitungan spora yang telah dilakukan. Setelah proses inkubasi, media perbanyakan bekatul, kulit kopi dan kulit kakao ditumbuhi jamur-jamur kontaminan yang sebagian besar dari golongan Aspergillus.
Berdasar hasil perhitungan jumlah spora pada tabel. Jumlah spora tertinggi diperoleh dari jamur Metarhizium dan Beauveria bassiana yang ditumbuhkan pada media jagung giling. Sedangkan pada media perbanyakan jagung-bekatul, kulit kopi dan kulit kakao mengalami kontaminasi. Kontaminan yang tumbuh pada media jagung bekatul, kulit kopi serta kulit kakao diduga berasal dari media yang kurang steril. Penggunaan bekatul, kulit kopi dan kulit kakao sebagai media tumbuh tanpa proses pemasakan diduga menjadi penyebab tumbuhnya kontaminan-kontaminan. Untuk itu perlu dilakukan uji kembali dengan metode persiapan media yang berbeda. Selain menggunakan metode penyiapan media yang berbeda, perlu dilakukan pemilihan media alternatif yang berbeda pula. Hal ini harus didasarkan pada kandungan nutrisi media yang dipilih. Kulit buah kakao (shel fod husk) adalah merupakan limbah agroindustri yang dihasilkan tanaman kakao (Theobroma cacao L.) Buah coklat yang terdiri dari 74 % kulit buah, 2 % plasenta dan 24 % biji. Hasil analisa proksimat mengandung 22 % protein dan 3-9 % lemak (Nasrullah dan A. Ella, 1993). Kulit buah kakao kandungan gizinya terdiri dari bahan kering (BK) 88 % protein kasar (PK) 8 %, serat kasar (SK) 40,1 % dan TDN 50,8 % dan penggunaannya oleh ternak ruminansia 30-40 %. Dari hasil penelitian yang dilakukan pada ternak domba, bahwa penggunaan kulit buah kakao dapat digunakan sebagai substitusi suplemen sebanyak 15 % atau 5 % dari ransum. Sebaiknya sebelum digunakan sebagai pakan ternak, limbah kulit buah kakao perlu difermentasikan terlebih dahulu untuk menurunkan kadar lignin yang sulit dicerna oleh hewan dan untuk meningkatkan kadar protein dari 6-8 % menjadi 12-15 %. Pemberian kulit buah kakao yang telah diproses pada ternak sapi dapat meningkatkan berat badan sapi sebesar 0,9 kg/ hari.
Berdasar informasi tersebut dapat diketahui bahwa kulit kakao kurang cocok dimanfaatkan sebagai media alternatif jamur Metarhizium dan Beauveria. Dengan kandungan lignin yang tinggi pada kulit kakao dapat menghambat proses penyerapan nutrisi. Beberapa jamur yang hanya dapat tumbuh pada kulit kakao adalah dari golongan Aspergillus. Jamur Aspergillus, terutama dari spesies niger biasa dimanfaatkan untuk menurunkan kadar lignin pada kulit kakao yang akan dimanfaatkan sebagai pakan ternak Dengan demikian kulit kakao kurang tepat digunakan sebagai media tumbuh jamur Metarhizium dan Beauveria. Hal ini didasarkan pada kandungan lignin pada kulit kakao yang menyebabkan jamur Metarhizium dan Beauveria mengalami kesulitan mendegradasi nutrisi pada kulit kakao. Sehingga pemanfaatan kulit kakao sebagai media perbanyakan jamur Metarhizium dan Beauveria bassiana perlu proses penurunan kadar lignin terlebih dahulu.
Lain halnya dengan media bekatul, bekatul adalah limbah hasil dari proses penggilingan padi. Menurut Grist (1986) dan Muchtadi, dkk (1995) dalam Ismnz (2006), bekatul merupakan hasil sampingan dari pengolahan padi/gabah yang berasal dari lapisan luar beras pecah kulit yang terdiri dari perikarp, lapisan aleuron, embrio, dan sedikit endosperm.Bekatul merupakan sumber serat pangan yang juga mengandung protein, lemak, mineral dan vitamin (Muchtadi, Nienaber dan Susana, 1995 dalam Ismnz, 2006). Kandungan vitamin yang terdapat pada bekatul antara lain seperti tiamin, riboflavin dan niasin sedangkan kandungan mineral yang dimiliki bekatul antara lain, seperti alumunium, kalsium, klor, besi, magnesium, mangan, fosfor, kalium, silikon, natrium dan seng (Betty, 2000 dalam Ismnz, 2006).
Dengan pertimbangan ketersediaan yang cukup serta nilai gizi bekatul yang tinggi, yaitu terdiri atas protein 14 persen, lemak 18 persen, karbohidrat 36 persen, abu 10 persen, serat kasar 12 persen, serta berbagai vitamin, hasil samping ini sangat potensial untuk dikembangkan (Pasopati, 2005). Dengan kandungan nutrisi yang cukup tinggi tersebut bekatul layak untuk dignakan sebagai media tumbuh jamur. Tetapi hasil uji yang telah dilakukan ternyata media bekatul maupun jagung yang dicampur dengan bekatul mengalami kontaminasi yang cukup tinggi. Kontaminan yang terbesar adalah dari golongan Aspergillus. Kontaminasi yang cukup besar dari media bekatul diduga kerena media bekatul tidak melalui proses pemasakan. Dari metode yang dilakukan media bekatul hanya disterilisasi. Untuk itu pada uji selanjutnya perlu adanya perubahan metode persiapan media bekatul.
Pada uji media ini viabilitas spora jamur Metarhizium dan Beauveria bassiana bernilai nol. Nilai tersebut terdapat di semua media uji. Media yang digunakan untuk menguji viabilitas adalah PDA (Potato Dekstrose Agar) datar dengan metode standar BPTP. Dengan kejadian tersebut maka perlu dilakukan analisa metode uji viabilitas dengan pertimbangan pengembangan metode yang sudah ada baik dari segi media yang digunakan maupun langkah-langkah metodologinya.
Dengan hasil tersebut maka Uji Media Perbanyakan Massal Jamur Entomopathogen perlu dilakukan kembali pada tahun berikutnya dengan menggunakan metode yang berbeda.
- V. Penutup
5.1. Kesimpulan
- Jagung masih merupakan media perbanyakan yang terbaik bagi pertumbuhan jamur Metarhizium dan Beauveria bassiana. Berdasarkan uji yang telah dilakukan, kualitas jamur dipandang dari jumlah spora, media jagung menghasilkan pertumbuhan jumlah spora yang lebih baik dibanding dengan media bekatul, kulit kopi dan kulit kakao.
- Kulit kakao dan kulit kopi kurang cocok dikembangkan sebagai media perbanyakan massal alternatif untuk jamur Metarhizium dan Beauveria bassiana.
- Penggunaan bekatul sebagai media perbanyakan memerlukan proses pemasakan terlebih dahulu sebelum digunakan.
- Metodologi persiapan media perlu perbaikan karena beberapa hasil uji banyak mengalami kontaminasi.
- Pemilihan media alternatif harus mempertimbangkan jumlah nurtisi yang dibutuhkan oleh jamur yang terkandung dalam media tersebut.
Tidak ada komentar:
Posting Komentar